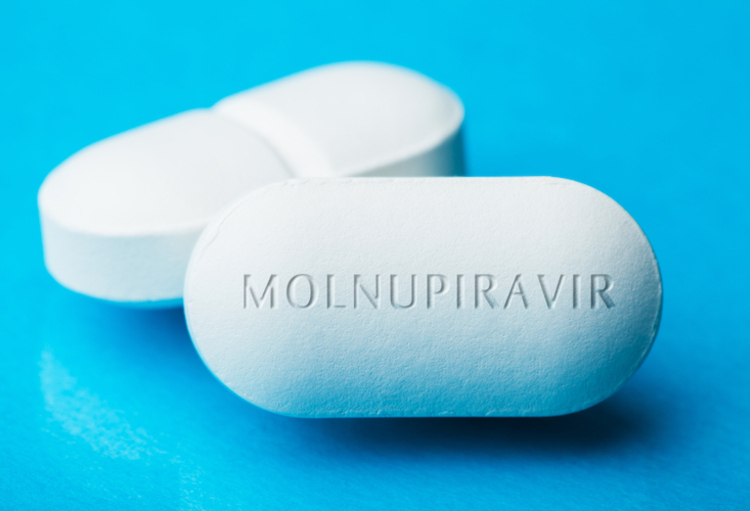
Het Europees geneesmiddelenagentschap EMA zou binnen enkele dagen kunnen beginnen met het onderzoeken van een pil van het Amerikaanse farmabedrijf Merck tegen COVID-19. Zo wordt het pad geëffend naar een mogelijke toelating in de Europese Unie. Dat maakte het EMA bekend.
Merck maakte vorige week bekend dat een klinische studie aantoonde dat het geneesmiddel, molnupiravir, het risico op hospitalisatie en overlijden door COVID-19 halveerde. Het zou een grote vooruitgang betekenen in de strijd tegen de pandemie.
Marco Cavaleri, de verantwoordelijke voor de vaccinstrategie van het EMA, zei dat overwogen wordt om de komende dagen een 'rolling review' te lanceren. Via zo'n onderzoek kan het EMA de data rond veiligheid en werkzaamheid beoordelen van zodra die binnenstromen. Een formele aanvraag van de fabrikant wordt dus niet afgewacht. Doel is om de beoordeling van een aanvraag te versnellen als die effectief ingediend wordt.
"We namen kennis van de eerste resultaten van het bedrijf", zei Cavaleri op een persconferentie van het EMA in Amsterdam. Merck kondigde vrijdag aan dat het binnenkort toelating wil vragen in de VS om de pil op de markt te brengen.